
Призрак смертельной опасности для человечества — антибиотикорезистентности — бродит по миру. Каковы причины возникшей угрозы и какие препараты могут спасти миллионы человеческих жизней
Три года назад Всемирная организация здравоохранения (ВОЗ) объявила, что человечество может остаться без эффективных лекарств против инфекций и погрузиться в постантибиотическую эпоху. Иными словами, любая хирургическая операция, включая кесарево сечение, пустяковая царапина с попавшей инфекцией, воспаление легких или туберкулез, скорее всего, приведут к смерти. Лечение же нелетальных бактериальных болезней станет затяжным и мучительным. Даже случаи заболевания бубонной чумой в США в августе 2017 года, которые выглядят просто страшилками в изложении желтой прессы, могут обернуться ужасной мировой эпидемией в мире без антибиотиков.

Мультирезистентный золотистый стафилококк (Staphylococcus aureus, MRSA) — одна из главных угроз человечества. Он с трудом поддается лечению, угрожает жизни человека и может привести к сепсису, пневмонии и инфекциям кровотока. Согласно статистике, от MRSA ежегодно умирают более 18 000 человек, заражается же им в пять раз больше (только инвазивно, при операциях). Более того, почти 9 из 10 заражений устойчивым золотистым стафилококком происходит в больницах, когда пациент лечится от другой болезни.
Получается, что прибывая на лечение в госпиталь, уже сейчас пациенты могут быть заражены этим смертельноопасным микроорганизмом. Вероятность такого события пока низка, но далее будет пояснено почему ситуация будет только ухудшаться. Поэтому антибиотикорезистентность (АБР) требует немедленных действий со стороны здравоохранительных организаций и широкой общественности, и в этом году Всемирная неделя правильного использования антибиотиков, объявленная ВОЗ, прошла 13–19 ноября.

По последним данным ВОЗ, три пункта в списке 10 ведущих причин смертности в мире занимают бактериальные инфекции или болезни, ими опосредованные (респираторные инфекции нижних дыхательных путей, диарейные болезни и туберкулез). И от них умирает каждый десятый человек в мире.
Глобальную ежегодную смертность от самых распространенных лекарственно-устойчивых штаммов инфекций оценивают минимум в 700 000 человек. Если ситуация не изменится, 100 млн человек к 2030 году умрут преждевременно, а через 35 лет эта цифра достигнет 300 млн. Мировая ежегодная смертность из-за АБР достигнет к 2050 году 10 млн.
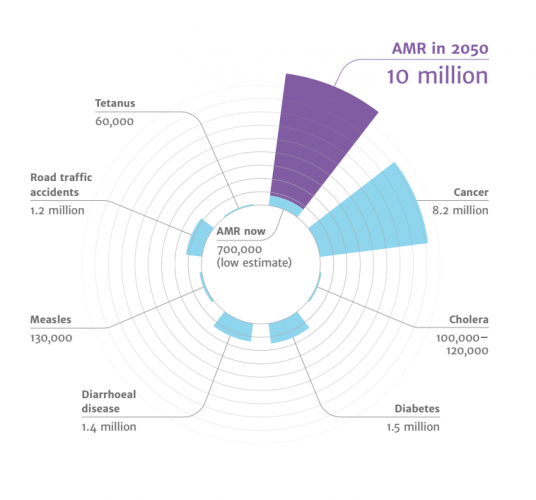
«Если мы не сможем никак на это повлиять, то мы сталкиваемся с почти немыслимым сценарием, в котором антибиотики перестают работать, а мы возвращаемся в темные века медицины», — прокомментировал ситуацию Дэвид Кэмерон, бывший премьер-министр Великобритании.
От первых открытий до наших дней
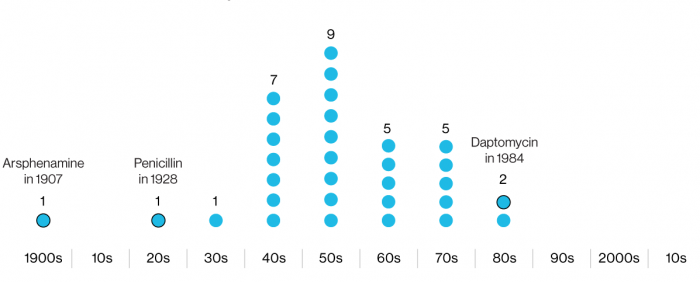
Тысячелетиями человечество боролось с микроорганизмами. Первый антибиотик — пенициллин — открыл британец Александр Флеминг в 1928 году. Широко использовать в клинике эту группу лекарств стали лишь в 40-х годах. Следующие два десятилетия считаются золотой эрой антибиотиков, но постепенно темп открытий сошел на нет, и сейчас антибактериальных лекарств, попадающих на рынок, крайне мало.
Много внимания уделяется веществам, нацеленным на клеточную стенку бактерий, которая часто защищает микроорганизм от действия антибиотика, как броня. Один из таких многообещающих препаратов — тейксобактин. Он известен еще и тем, что его разработчики создали уникальную технологию культивирования микроорганизмов iChip, которая может значительно облегчить поиск новых антибиотиков. Другое перспективное лекарство — лугдунин. Он эффективно справляется с мультирезистентным золотистым стафилококком, самой опасной супербактерией. Однако, к сожалению, гарантии того, что бактерии не выработают устойчивость и к этим препаратам, нет.
Потребление же антибиотиков во всем мире за 2000–2010 годы выросло более чем на треть, согласно работе исследователей из Принстонского университета. За три четверти этого всплеска ответственны пять стран — Бразилия, Россия, Индия, Китай и Южно-Африканская Республика (БРИКС).
Свою лепту вносят и США. Хотя общий объем принимаемых антибактериальных препаратов за указанный период времени по сравнению с БРИКС не очень изменился, в Америке на душу населения потребляется гораздо больше антибиотиков, чем в любой другой стране: к примеру, разница с Индией больше чем в два раза.
Как возникает АБР?

Когда говорят об АБР, подразумевают, что микроорганизмы выживают после воздействия лекарств, которые раньше их убивали или хотя бы останавливали рост. Однако это отнюдь не новое явление: это естественный процесс, о существовании которого известно со времени открытия этих лекарств. Тем не менее проблема стала глобальной только недавно из-за чрезмерного употребления антибиотиков во многих сферах жизнедеятельности человека, включая медицину и животноводство.
Кто виноват?
Крупные фармкомпании в последние годы перестают вкладывать средства в исследования новых антибиотиков. В период с 2003 по 2013 годы инвестиции венчурного капитала в исследования и разработки, посвященные антибиотикам, составили менее 5%: всего $1,8 млрд из $38 млрд. Pfizer в 2011 году закрыл специализированный центр по разработке антибиотиков в Коннектикуте и частично перефокусировался на исследования по антибактериальным вакцинам. Фармгиганты, отказывающиеся от подобных разработок, — это Johnson & Johnson, Roche, Bristol-Myers Squibb и Eli Lilly. Одной из последних сдалась AstraZeneca: британцы сначала уменьшили инвестиции в эту отрасль, а в прошлом году и вовсе продали свой бизнес по изучению малых молекул антибиотиков на поздних стадиях исследований за более чем $1,5 млрд. Вместо этого компания планирует сосредоточиться на респираторных, сердечно-сосудистых и аутоиммунных заболеваниях, метаболических расстройствах и онкологии.
GlaxoSmithKline, одна из немногих оставшихся в этой отрасли крупных компаний, за последние 10 лет потратила около $1 млрд собственных денег на исследования по поиску новых антибактериальных препаратов. Однако они расходуют не только свои средства: Управление контроля за нераспространением оружия массового поражения (ОМП) министерства обороны США (The Defense Threat Reduction Agency) предоставило им суммарное финансирование на исследования по антибиотикам в размере более $200 млн.
Результаты исследований их нового препарата гепотидацина выглядят многообещающе — однако до выхода на рынок ему пока далеко.
Почему же за последнее время появилось так мало новых антибиотиков? Как получилось, что, говоря словами Аннет Хайнцельманн из организации Médecins Sans Frontières, существующая система R&D (research & development) в фармацевтике не всегда разрабатывает именно те лекарства, которые нужны? Ответ прост: процесс разработки препарата и вывода его на рынок слишком затратны и продолжительны, гарантии на успех нет, а прибыли от продаж слишком малы. Поддержки же от государств, международных здравоохранительных организаций и органов, регулирующих процесс одобрения новых лекарств, не было. Долгое игнорирование проблемы властями разных стран дополнительно ухудшило ситуацию.
Запуск препарата стоит около $1 млрди может растянуться на десятилетие, по словам Роя Андерсона из Императорского колледжа в Лондоне и члена совета GlaxoSmithKline. Кроме того, затраты могут непредсказуемо вырасти, поскольку требуются сложные клинические испытания на пациентах с опасными для жизни инфекциями, а в итоге, согласно Pew Charitable Trusts, после тестирования на людях регулирующие органы одобряют только один из пяти антибиотиков.
От продаж тоже многого ожидать не приходится из-за низких цен на антибиотики. «Обычно все пишут, что в целом лекарства слишком дорогие, но в случае антибиотиков — они слишком дешевые. Большая фарма решила перенаправить R&D в сторону так называемой хронической терапии, и они ищут препараты для лечения болезни Альцгеймера, рака, гипертонии или диабета», — рассказывает DDD magazine главный исполнительный директор молодой компании MotifBio, специализирующейся на разработке новых антибиотиков, Грэм Ламсден. Cамая успешная разработка MotifBio — антибиотик иклаприм против резистентных стафилококков — сейчас находится на последних стадиях клинических испытаний.
Такие объяснения и у и управляющих крупнейших фармкомпаний. «Рыночная ниша для нового антибиотика очень мала, прибыли там нет, вот и капитал не течет, — говорит Пол Стоффелс, глава фармкомпании Johnson & Johnson. — В случае онкологии люди платят $30 тыс, $50 тыс, $80 тыс (на одного пациента) за препарат, а для антибиотика это всего лишь несколько сотен долларов».
Государство на страже
Для государства антибиотикорезистентность опасна угрозой не только жизням граждан, но и бюджету. В год только в США дополнительно тратится более $20 млрд на здравоохранение. Страдает и американская экономика: потери из-за снижения производительности труда оценивают в $35 млрд. Затраты на борьбу с АБР к 2050 году обойдутся миру в огромную сумму: до 3,5% от его общего ВВП или до $100 триллионов. В более же обозримой перспективе, мировой ВВП уменьшится на 0,5% к 2020 году и на 1,4% к 2030 году.
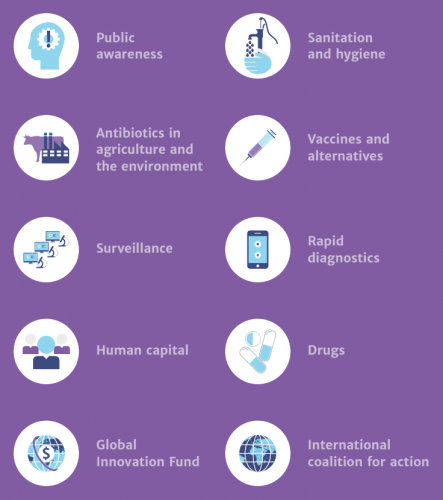
Чтобы предотвратить это, многие страны решили действовать — как по-отдельности, так и сообща. Это привело к созданию множества программ по борьбе с устойчивостью бактерий. Главные их постулаты сходятся: это улучшение диагностики инфекционных заболеваний и определения резистентных бактерий, изменение подхода к использованию антибиотиков в различных областях, включая животноводство, разработка новых лекарств и антимикробных вакцин, и, наконец, объединение государств, фармпромышленности, научного сообщества и простых людей для борьбы — фактически за выживание человечества.
В США в 2014 году опубликовали «Национальную стратегию Белого дома по борьбе с антибиотикорезистентными бактериями», в реализации которой важное место принадлежит Центрам по контролю и профилактике заболеваний (CDC).
Кроме того, в 2012 году Конгресс принял Закон об инновациях и безопасности в сфере контроля за лекарствами и потребительскими продуктами. Восьмая часть закона стала широко известна под аббревиатурой GAIN (Generating Antibiotic Incentives Now, дословно «создание условий для инвестиций в антибиотики сейчас»). Она требовала от Управления по контролю за продуктами и лекарствами (FDA) — главного органа контроля за процессом одобрения новых лекарств в США — предпринять шаги, стимулирующие производителей инвестировать в разработку антибиотиков. Среди прочего, она повлияла на ускорение процесса одобрения этих препаратов и предоставляла дополнительные пять лет эксклюзивности на рынке. FDA же по итогам должно было пересмотреть и составить новые четкие рекомендации по разработке антибиотиков, нацеленных на определенные бактерии. К сожалению, эта инициатива не полностью увенчалась успехом — в этом году фармкомпании попросили прояснения этого акта.
США также объединились с Великобританией для создания CARB-X — возможно, самого крупного государственно-частного сотрудничества в мире. Его цель — доклинические исследования антибиотиков, на которые выделено около полумиллиарда долларов.
Помимо этого, Великобритания и Китай договорились внести по $72 миллиона в только что созданный Глобальный инновационный фонд, чья цель — сотрудничество с другими подобными организациями и координация финансирования исследований по АБР во всем мире.
Кроме того, в 2014 году Большая фарма в лице Astellas, AstraZeneca, Cubist, GlaxoSmithKline, Roche, Pfizer and Sanofi присоединилась к инициативе ЕС DRIVE‐AB (Driving Reinvestment in R&D and Responsible Antibiotic Use) по разработке новых, более финансово выгодных экономических моделей ведения исследований по антибиотикам. Участники надеются, что в итоге удастся разработать стратегию привлечения инвестиций в эту область.
Наконец, фармкомпании в прошлом году создали свою коалицию по мониторингу устойчивости бактерий. Краеугольным камнем этого альянса стала «Декларация по борьбе с антибиотикорезистентностью», принятая представителями фармацевтической, биотехнологической и диагностической промышленности. Результаты их работы объявят в 2018 году.
Российская ситуация
Как же борьба с АБР идет в России? С одной стороны, реальность угрозы очевидна всем. К примеру, создана карта чувствительности микроорганизмов к антибиотикам по всей стране, а Минздрав буквально пару месяцев назад внес в Правительство Российской Федерации «Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года». И на Московском международном форуме «Открытые инновации» 2017 года в обсуждении на тему антибиотикорезистентности подчеркнули необходимость создания на базе «Сколково» рабочей группы и программы по борьбе с антибиотикорезистентностью, аналогичной уже разработанным в других странах.
С другой стороны, на получении средств от государства это не сказалось, и исследования по созданию новых антибиотиков не ведутся. По крайней мере, так считает Владимир Рафальский, директор Института клинической фармакологии и член президиума Альянса клинических химиотерапевтов и микробиологов. «Новые молекулы не создаются… Причина такой ситуации банальная – отсутствие финансирования», — рассказывает эксперт, по сообщению ресурса «Медвестник». Однако некоторые российские ученые планируют самостоятельно вывести свои разработки на рынок. Исследователи из компании «Аллофарм» уже долгое время занимаются изучением антимикробных молекул иммунной системы насекомых, которые защищают их от бактерий в естественных условиях. Сейчас работу ведут над комплексом FLIP7 . Это комбинация пептидов из четырех семейств: дефензинов, цекропинов, диптерицинов и пролин-богатых пептидов. Первые нацелены преимущественно на мембраны грамположительных бактерий (все бактерии делятся на грамположительные и грамотрицательные в зависимости от реакции на окрашивание специфическим реагентом: разница обусловлена различным составом и толщиной клеточной стенки бактерий), вторые и третьи — на грамотрицательных, а последние направлены на внутриклеточные мишени. Те бактерии, которые оказываются чувствительны к такому «коктейлю», не вырабатывают к нему устойчивости. Синтез комплекса активных веществ FLIP7 уже налажен и отработан, как и метод борьбы с бактериальными пленками при использовании FLIP7 с антибиотиком. Кроме того, компания получила патент на изобретение сроком до 2030 года и подала заявку на патентование способа повышения антибиопленочной активности антибиотиков путем совместного применения с комплексом FLIP7.
В разработку за пять лет было вложено уже более $500 000. Эксперты из «Сколково» признали его технически реализуемым, конкурентоспособным и обладающим потенциалом коммерциализации. Сейчас компания ведет поиск венчурных инвестиций для создания автоматизированной промышленной линии массового биосинтеза и сбора комплекса FLIP7.
Новый перспективный объект для исследователей — это потенциаторы, соединения, которые в комбинации с антибиотиком усиливают его действие. Они борются с уже устойчивыми к лечению бактериями, не требуют разработки новых и, возможно, помогут вернуть в клинику старые антибиотики.
Подобные потенциаторы сейчас активно изучает команда российских ученых из компании Superbug Solutions UK Ltd. (Sbsplatform.io), резидента «Сколково». Исследователи работают над молекулами класса алкилрезорцинов — в естественных условиях подобные соединения выделяют, например, микробы и растения для защиты от паразитов. Они проникают внутрь бактерии и нарушают работу ключевых процессов ее жизнедеятельности, действуя на несколько мишеней одновременно: на мембраны, различные белки и геном бактерий. В результате у микроорганизма развивается стресс, а антибиотик получает более легкий доступ к своей цели.
Лучшего результата от применения алкилрезорцинов можно достичь в сочетании с антимикробными средствами. Такую ударную комбинацию высоких доз антибиотика с исследуемыми молекулами назвали «суперпулей» (superbullet). Количество бактерий, выживающих после атаки таким оружием, ниже на 3-5 порядков (в 1000-100 000 раз) по сравнению с действием антибиотика в одиночку. Разработчики утверждают, что эффективность лечения инфекционных заболеваний с использованием таких бинарных препаратов повышается, даже если болезнь вызвана устойчивыми к лекарствам патогенами резистентными патогенами. Развитие же устойчивости к лекарству при этом замедляется в 10—30 раз. Минимальная ингибирующая концентрация, то есть самая низкая концентрация препарата, которая полностью угнетает рост бактерий, в некоторых случаях снижалась до 500 раз.
Изучив множество алкилрезорцинов, исследователи выбрали самый перспективный из них — М13 (точная формула — коммерческая тайна). Исследования на мышах, зараженных смертельно опасной клебсиеллезной инфекцией, показали, что эффективность лечения антибиотиками в комбинации с М13 действительно повышается.
Европейская Комиссия признала разработку конкурентоспособной и инновационной, а также рекомендовала для инвестирования в программе Европейского Союза по научным исследованиям и инновациям «Горизонт 2020» (Horizon 2020). Superbug Solutions запланировала будущие эксперименты по изучению алкилрезорцинов и сейчас работает с 19 эффективными комбинациями с антибиотиками.
После этих опытов разработчики перейдут к клиническим исследованиям. Средства же на испытания и продвижение препарата рассчитывают собрать путем международного краудфандинга без привлечения финансирования от Большой фармы.
Заключение
Антибиотикорезистентность «поражает» всё новые штаммы бактерий, а инструментов борьбы с ней все еще немного. Что же дальше: темные века медицины без антибиотиков, либо же новый мир с другим подходом к лечению инфекций? Возможно, вопрос упирается в то, насколько удастся объединить общие усилия по борьбе с АБР и вовлечь общественность в эту войну — ведь она касается каждого. Однако исход этой битвы пока не ясен.
Текст опубликован в рамках спецпроекта Forbes и научно-популярного портала «Биомолекула», посвященного достижениям молекулярной биологии и их внедрению в биотехнологиях и медицине. Расширенная версия статьи — на сайте «Биомолекулы».
 Трудовой Кодекс РФ с комментариями ТК РФ, бесплатные консультации юристов
Трудовой Кодекс РФ с комментариями ТК РФ, бесплатные консультации юристов

