
Клеточная терапия и редактирование генома могут кардинально изменить то, что мы называем «обезболивающими». Впрочем, обезболивающие лейкопластыри, кажется, все равно не исчезнут.
Недавно в авторитетном журнале Annals of the Rheumatic Diseases была опубликована статья, анализирующая данные 35 различных испытаний нестероидных противовоспалительных средств для лечения боли в области спины. Пациенты чувствовали облегчение, однако по сравнению с группами, принимавшими плацебо, эффект тестируемых средств оказался несущественным. Низкая эффективность этих средств предполагает увеличение курса приёма, а это чревато серьёзными осложнениями: увеличению риска сердечно-сосудистых заболеваний таких, как тромбообразование, инфаркт миокарда, инсульт и расстройство желудочно-кишечного тракта, включая образование язвы. Что делать: переходить на наркотические препараты или верить в спасительную силу самовнушения? Такая проблема уже решалась «доктором Хаусом» в одноимённом сериале.
Очень часто такой выбор приводит к наиболее простому и наиболее пагубному решению. Около 75% американцев, потребляющий героин, начали принимать их после того, как выпили курс прописанных по рецепту врача опиоидов. Тысячи пациентов стоят в очередях в клинические центры за получением обезболивающих лекарств и не все получают их. Некоторые решаются на отчаянный шаг и покупают героин, поскольку он часто оказывается дешевле таблеток. Сегодня действительно существует острая необходимость в разработке новых методов лечения и лекарств, которые могли бы применяться для избавления от боли и не иметь побочных эффектов. И такие методики могут быть созданы на основе многочисленных научных данных, кому-нибудь нужно просто решиться вывести новые разработки на рынок, отказавшись от лёгкой добычи денег на производстве старых препаратов. Между тем, последних довольно много. По данным Министерства здравоохранения России, доля дженериков (аналогов широко известных и повсеместно используемых препаратов, чей срок эксклюзивного использования по патентам уже истёк) в нашей стране составляет 77%, в то время, как в США они занимают 12% рынка, в Японии – 30%, в Германии – 35%, а во Франции – 50%.
Последние прорывы в изучении генома человека и исследовании отличий в физиологических процессах у людей, страдающих генетически унаследованными заболеваниями, позволили определить основные цели (молекулярные мишени), по которым следует направленно бить медикаментами для снятия болевых синдромов. Список основных мишеней был составлен и до успехов генодиагностики, но с её помощью он постоянно пополняется и находятся новые патологические варианты. Дело осталось за главным: надо найти эффективные и селективные лекарства к этим мишеням и доказать безопасность их применения.
Боль как эмоция формируется в мозге, но для её появления сигнал о нежелательном воздействии или проблеме, возникшей в конкретном месте организма, должен быть изначально сформирован и доставлен. Существует строго отлаженная цепочка передачи болевого сигнала от поврежденного места в мозг – ноцицепция. В этой системе задействовано очень много нейронов (нервных клеток), которые могут генерировать сигнал в ответ на опасность или получать сигнал от соседнего нейрона и передавать его дальше по цепочке следующему нейрону. Любой разрыв в этой схеме передачи болевого сигнала в итоге приводит к потере болевой чувствительности, при этом опасность разрушения организма остаётся неизменной. Медикаментозное воздействие именно на клетки, участвующие в этой цепочке, – ноцицепторы – можно рассматривать как наиболее эффективный способ борьбы с болью.
На уровне разрыва цепи передачи боли работают ненаркотические анестетики. Лидокаин – самый известный препарат, который на время блокирует проводимость всех потенциал-зависимых натриевых каналов. Это препятствует прохождению любых импульсов, а не только болевого сигнала, поэтому применять его можно недолго, только местно и в строго выверенных дозах. После разрушения анестетиков в печени чувствительность нейронов полностью восстанавливается и болевой сигнал, генерируемый в очаге поражения, снова начинает поступать в головной мозг в том же объёме.
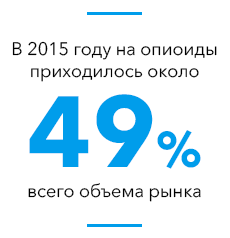
Другие обезболивающие средства – на основе опиоидов – способны активировать опиоидные рецепторы, что приводит к неспособности мозга распознавать болевые стимулы от периферической нервной системы. Сейчас Всемирная Организация Здравоохранения и Минздрав России в своем перечне жизненно необходимых и важнейших лекарственных препаратов для медицинского применения (ЖНВЛП) рекомендуют использовать морфин, тримеперидин, трамадол, фентанил и слабый наркотический аналог кодеин, как средства против острой и хронической боли. Но даже кодеин, компонент ряда безрецептурных препаратов, со временем вызывает эффект привыкания и развитие наркотической зависимости. Так что все опиоидные препараты неприемлемы для длительного или повседневного применения активной частью населения.
Для массового повседневного использования в аптеке можно купить обезболивающие лекарства группы нестероидные противовоспалительные средства (НПВС). Именно ими мы обычно и пытаемся заглушить нашу боль. Самая распространённая четверка: аспирин (ацетилсалициловая кислота), парацетамол, ибупрофен и анальгин. В перечень ЖНВЛП попали еще диклофенак, кеторолак, лорноксикам, кетопрофен. Нестероидные препараты подавляют воспаление, препятствуя выделению простогландинов – клеточных воспалительных медиаторов.
На этом арсенал обезболивающих средств по большому счёту и заканчивается. Уже долгое время нет принципиально новых лекарств, фармкомпании соревнуются преимущественно в разработке различных модификаций опиоидов или НПВС, подбирают условия замедленного высвобождения активной формы или варьируют компонентный состав для минимизации побочных эффектов. То есть на лицо мы имеем экстенсивный путь развития в попытке хоть как-то поддержать на плаву лекарства с сомнительными потребительскими свойствами.
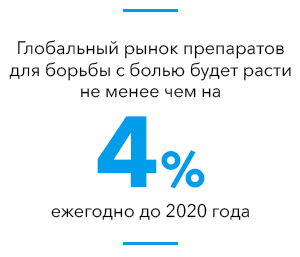
Все крупные и мелкие фармацевтические компании занимаются разработкой анальгетических средств. И всем понятно, за что они борются. Боль сегодня – проблема мирового масштаба. По данным опроса населения в США, распространённость хронической боли (определяемой как рецидивирующей или долговечной болью в течение шести месяцев и более) составила 30,7%. Распространённость хронической боли выше у женщин (34,3%), чем мужчин (26,7%), и увеличивается с возрастом. Анализ более ранних опросов, проведённых в странах Европейского Союза, дал сходные цифры в 25-35% населения, страдающего от хронических болей.
Статистика расходов на лечение боли впечатляет. За 2008 год в США за медицинской помощью обратилось порядка 100 миллионов взрослых. Учитывая общие расходы на здравоохранение США и ежегодные затраты, связанные с более низкой производительностью труда, общая сумма годовых расходов достигает $635 млрд. Доля расходов на здравоохранение, там, где необходимо купировать или лечить боль, при этом была оценена в $300 млрд. (2012 г.). Эти данные по общим расходам включают, прежде всего, дорогостоящую госпитализацию и компенсации за потерю трудоспособности, но суммы затрат и объём рынка обезболивающих лекарств всё равно остаются более чем значительными. При этом интересно сравнить затраты на обезболивающие лекарства с затратами на лечение рака ($243 млрд.) и диабета ($188 млрд.).
В странах с меньшим уровнем дохода на душу населения, в том числе Российской Федерации, нельзя ожидать столь же большого потребления лекарственных средств и уровня доходности от их реализации. По последним данным маркетингового агентства DSM Group, недельные продажи через аптечную сеть стабильно держатся на уровне 15 млрд. рублей, из них анальгетики занимают около 3% рынка лекарств в стоимостном выражении. Тогда, по грубым оценкам, годовой рынок анальгетических препаратов для России составляет более 20 млрд. рублей.
Как могут инновационные препараты выйти на рынок? Прежде всего, нужно определить основную молекулярную мишень, на которую новый препарат действует. Для этого предусмотрен модный термин «таргетность». Именно преимущественное направленное действие на одну мишень позволяет ожидать, что препарат будет корректировать работу только определённого клеточного компонента и не будет изменять функционирование соседних систем клеточной жизнедеятельности.
В случае НПВС мы имеем дело с абсолютно неспецифическим действием. Для многих лекарств этой группы экспериментально было показано модулирующее действие на различные ионные каналы. Активность на такие каналы (важные рецепторы преимущественно сердечных, иммунных и нервных клеток) была немного ниже основной активности НПВС, направленной на подавление клеточного синтеза воспалительных агентов. Но есть большая вероятность, что положительные эффекты НПВС (помимо обезболивающего действия) и часть наблюдаемых побочных эффектов связана именно с действием по не основным клеточным мишеням. Насколько специфично будет препарат работать внутри организма, изначально оценивают в лабораториях на модельных системах на уровне отдельно взятой клетки. Крупные компании традиционно проводят масштабные измерения огромных библиотек химических соединений на определённые рецепторы боли, которые искусственно внедрены в изучаемые клетки. Таким же путём идут и различные научные подразделения при мелких инновационных компаниях или исследовательских университетах. Не будучи оригинальными, такую схему поиска перспективных молекул практикуем и мы в Институте биоорганической химии РАН.

При поддержке Минпромторга и Минобрнауки уже шесть лет проводятся мероприятия по тематике «Доклинические исследования инновационных лекарственных средств». Такая программа позволила оценить ориентировочный потенциал лекарств для разработчиков и возможных инвесторов. Разработки из нашего института были достойно представлены как кандидаты на инновационные лекарственные препараты.
Наши анальгетики, в практический потенциал и безопасность которых мы верим, ориентированы на рецепторы, распознающие кислоту, температуру и внеклеточные метаболиты, выделяемые при развитии воспаления. Так как они способны на уровне первичных чувствительных нейронов блокировать возникновение болевого сигнала (через ингибирование рецепторов), то далее по всей восходящей цепочке ноцицепции никакой активации не произойдет и мозг не получает сигнала боли. Ещё никто пока не вывел лекарственные препараты с такой клеточной мишенью действия на мировые рынки. Это связано, как с нежеланием отходить от традиционных доходных лекарств ведущими производителями, так и с неудачей нескольких химических соединений в доклинических испытаниях и в первой фазе клинических испытаний. Но поиск прототипов лекарств, нацеленных на эти рецепторы, очень активно продолжается, что отражается в количестве патентов, регистрируемых ежегодно по данной тематике.
Даже при активном противодействии, в скором времени анальгетические препараты ненаркотической природы и не относящиеся к НПВС пробьют сопротивление и будут появляться на рынке. Объективное желание задействовать как можно больше механизмов регуляции боли идёт в том числе и от врачей, которые сегодня стеснены в выборе препаратов и постоянно комбинируют одно с другим, особенно если речь идёт о сложных онкологических заболеваниях. Со своей стороны учёные, вовлеченные в эту проблему, накопили много экспериментальных и практических данных по клеточным мишеням, на которые надо направленно воздействовать, и перспективным молекулам, которые надо внедрять в практику. Работа уже проведена большая и отлично сделана. Но кто-то должен заняться внедрением инновационных препаратов и поверить в их потенциал. Основное препятствие – в больших финансовых затратах при серьёзных рисках внедрения на проведение всех стадий клинического исследования и регистрации конечного лекарственного средства.
В перспективе 50-100 лет лекарства в современном понимании, скорее всего, перестанут существовать вообще. Здесь наиболее явно встаёт перспектива клеточной терапии и редактирование геномов пациентов в терапевтических целях. Расшифровав геном пациента, можно определить, есть ли у него патологические мутации, приводящие к неправильной работе той или иной системы жизнеобеспечения организма. Конкретные патологические мутации можно будет исправить. Если таких мутаций нет, а заболевание диагностируется со всеми вытекающими симптомами, то наиболее вероятно, что на уровне специализированных клеток организма необходимых активных белковых молекул производится слишком много или недостаточно. Современные лекарственные средства нацелены пока на регулирование уровня активности клетки извне через кровоснабжение, лекарства будущего будут исправлять работу отдельных клеток, возвращая их в исходнозапрограмированное состояние. Когда все клетки будут здоровы, применять лекарства (в современном смысле этого понятия) не будет необходимостью. В этом случае нежелательные боли не будут нас беспокоить более, а восприятие обычной боли, как системы сохранения нашего тела, останется неизменной. Надо, возможно, порадоваться за наших потомков, но пока технологии ещё не достигли совершенства и не проверены временем, мы будем постоянно использовать таблетки, уколы, свечи, лейкопластыри и капельницы с обезболивающими агентами. Хотя обезболивающие лейкопластыри, скорее всего, не исчезнут никогда.
 Трудовой Кодекс РФ с комментариями ТК РФ, бесплатные консультации юристов
Трудовой Кодекс РФ с комментариями ТК РФ, бесплатные консультации юристов

